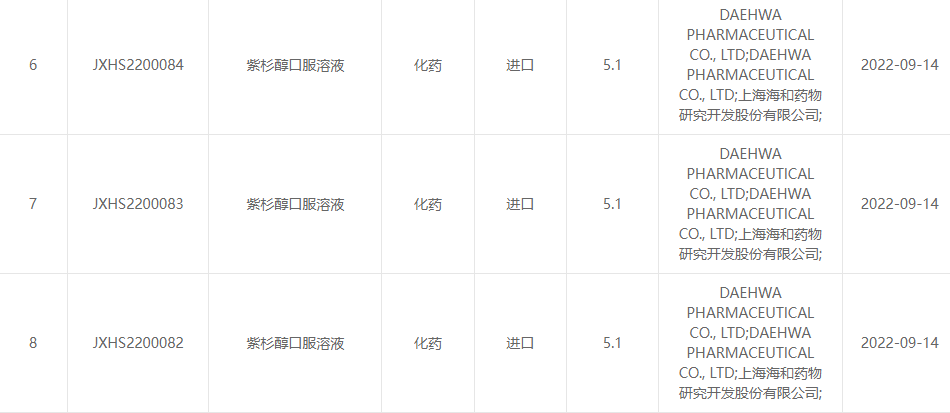
13. syyskuuta 2022 Shanghai Haihe Pharmaceutical Research and Development Co., Ltd. ja Daehwa Pharmaceutical Co., Ltd. ilmoittivat yhdessä, että osapuolten yhteisesti kehittämä paklitakselin oraaliliuos (RMX3001) on virallisesti hyväksytty lääkekeskuksessa. Valtion lääkeviraston arviointi (CDE).(Hyväksyntänumero: JXHS2200082 maa, JXHS2200083 maa, JXHS2200084 maa).
Kuvan lähde: Valtion lääkevirasto
PaklitakseliSitä käytetään laajalti erilaisten pahanlaatuisten kasvainten, kuten keuhkosyövän, rintasyövän, munasarjasyövän, pään ja kaulan syövän sekä mahasyövän hoidossa.Proteiinipolymerointi, mikrotubulusten kokoonpano, joka estää depolymeroitumisen, stabiloi siten mikrotubuluksia ja estää syöpäsolujen mitoosia ja laukaisee apoptoosin, mikä estää tehokkaasti syöpäsolujen lisääntymisen ja toimii syöpää vastaan.
Tällä hetkellä suurimmassa osassa maailmaa käytetään paklitakselia injektiona, joka on formuloitava ja annettava laskimoon tiputuksena sairaalassa.Potilaiden on palattava sairaalaan usein, ja pistoskohdassa esiintyy haittavaikutuksia.Siksi oraalisten paklitakselivalmisteiden kehittäminen on aina ollut kuuma paikka teollisuuden tutkimuksessa..
RMX3001 on Dahua Pharmaceuticalin kehittämä paklitakselin oraalinen formulaatio, joka perustuu sen innovatiiviseen lipidejä emulgoivaan lääkkeenantotekniikkaan.Korean elintarvike- ja lääkevirasto on hyväksynyt sen syyskuussa 2016 (kauppanimi Liporaxel), ja käyttöaiheena on pitkälle edennyt tai toisen linjan metastaattisen mahasyövän tai paikallisesti uusiutuvan mahasyövän hoito.Haihe Pharmaceuticalsin lehdistötiedotteen mukaan Liporaxel on ensimmäinen oraalinen paklitakselituote, joka on tähän mennessä onnistuneesti kehitetty ja hyväksytty markkinointiin maailmassa.Syyskuussa 2017 Haihe Pharmaceutical hankki Dahua Pharmaceuticalsilta tuotteen tuotekehitys-, tuotanto- ja myyntioikeudet Manner-Kiinassa, Hongkongissa, Taiwanissa ja Thaimaassa.
RMX3001:n listaushakemus Kiinassa perustuu pääasiassa satunnaistettuun, avoimeen, rinnakkaiskontrolloituun, ei-alempiarvoisuussuunnitteluun, monikeskuksen vaiheen 3 kliiniseen tutkimukseen, jonka tarkoituksena on verrata paklitakselin RMX3001-oraaliliuoksen toisen linjan hoitoa. paklitakselin injektio (Taxol) Teho ja turvallisuus potilailla, joilla on edennyt mahasyöpä.Tutkimuksen suorittivat yhdessä professori Li Jin Shanghai Oriental Hospitalista ja professori Qin Shukui Nanjing Jinlingin sairaalasta päätutkijoina.
Tohtori Ruiping Dong, Haihe Pharmaceuticalsin toimitusjohtaja, sanoi: "Paklitakselin oraaliliuosta (RMX3001) koskevan hakemuksen hyväksyminen on toinen tärkeä virstanpylväs Haihe Pharmaceuticalsille, ja olen erittäin kiitollinen kliinisille tutkijoille ja potilaille, jotka osallistuivat tutkimukseemme. oikeudenkäyntiä.Pitkälle edennyt mahasyöpä Kliininen hoitotarve on edelleen valtava, ja toivomme voivamme tuoda maailman huippuluokan innovatiiviset ja kätevimmat hoidot potilaille Kiinassa ja ympäri maailmaa mahdollisimman pian.
Yunnan Hande Biotechnology Co., Ltd. on keskittynyt paklitakselin tuotantoon 28 vuoden ajan.Se on maailman ensimmäinen riippumaton kasviperäisen syöpälääkkeen paklitakselin valmistaja, jonka ovat hyväksyneet Yhdysvaltain FDA, Euroopan EDQM, Australian TGA, Kiinan CFDA, Intia, Japani ja muut kansalliset sääntelyvirastot.yritys.Jos haluat ostaaPaclitaxel API,ota meihin yhteyttä verkossa.
Postitusaika: 14.9.2022